Über die letzten Jahrzehnte haben Medizinproduktehersteller FMEA als Werkzeug zur Risikoanalyse eingesetzt. Eine näherer Betrachtung der regulativen und normativen Forderungen zum Risikomanagement von Medizinprodukten zeigt, dass FMEA diese Forderungen nicht ausreichend erfüllt.
Das Problem
Die Norm ISO 14971:2019 gibt FMEA als eines der Werkzeuge im Risikomanagement an. Dabei wird jedoch nicht darauf hingewiesen, dass FMEA als Werkzeug zur Analyse von Risiken nicht geeignet ist?
Das Problem wird deutlich, wenn man sich die Verwendung des Bergriffs „Risiko“, wie er im Zusammenhang mit FMEA und wie er in der NORM ISO 14971:2019 definiert ist betrachtet.
Begriffsunterschiede
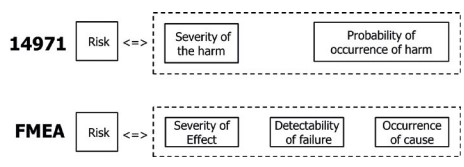
Die ISO 14971:2019 definiert „Risiko als:
„Kombination der Wahrscheinlichkeit des Auftretens eines Schadens und des Schweregrades dieses Schadens“
Die FMEA definiert „Risiko“ als: „Kombination des Schweregrad der Folge, der Entdeckbarkeit des Fehlersund der Auftretenswahrscheinlichkeit der Ursache des Fehlers.“
„Risiko“ aus Sicht der FMEA
Die FMEA fokussiert auf den Fehler des Produktes. Es wird abgeschätzt, wie wahrscheinlich die Ursache für einen Fehler am Produkt eintritt, wie wahrscheinlich der Fehler am Produkt entdeckt wird und wie schwerwiegend die Folgen von fehlerhaften Produkten sind.
Die FMEA berücksichtigt nicht, dass eine Kette an Ereignissen notwendig ist, damit ein Medizinprodukt tatsächlich Schäden verursacht. Jeder Fehler am Produkt führt quasi immer zum Schaden.
„Risiko“ aus Sicht der Norm ISO 14971:2019
Die 14971 fokussiert dagegen auf die Auswirkungen von Fehlern des Medizinprodukts. Ausgehend vom fehlerhaften Medizinprodukt (Gefahr) wird abgeschätzt, wie wahrscheinlich Schäden eintreten werden und wie schwerwiegend diese Schäden sind.
Die Risikoanalyse berücksichtigt, dass eine Kette an Ereignissen notwendig ist, damit ein Medizinprodukt tatsächlich Schäden verursacht. Somit wird sichtbar, dass nicht jedes fehlerhafte Produkt zu einem Schaden führen wird.
Die Risikoanalyse ermöglicht abzuschätzen, ob die Häufigkeit von Schäden einer Schweregradstufe gesellschaftlich akzeptierbar ist. Nur so gelingt auch eine sinnvolle „Nutzen-Risiko-Abwägung.
Ergebnis
Wenn Medizinproduktehersteller nur FMEA als Werkzeug zur Risikoanalyse einsetzen, erfüllten sie die regulativen und normativen Forderungen für Medizinprodukte nicht.
Autor: Bernhard Lindner, MSc.

